
|
名称
|
品牌
|
货号
|
规格
|
保存
|
|
RNA小量提取试剂盒(50)
RNeasy Mini Kit (50)
|
Qiagen
|
74104
|
50次
|
RT
|
一、产品详情
RNeasy试剂盒是总RNA分离的金标准。它们使用硅膜RNeasy旋转柱或96孔板,可以从小到大数量的细胞、组织和酵母中快速纯化高质量的RNA。组织样本可以方便地使用RNA保护组织试剂或所有保护组织试剂来稳定,并使用组织分子ll或组织分子ll或LT系统来有效地破坏。RNeasy 96 Kit可以使用二氧化硅膜RNeasy 96板从多达96个培养的细胞样本中高通量纯化总RINA。一个专用的RNeasyQIAcube工具包可以在QlAcube连接上自动纯化1-12个样品。
二、产品特点
●快速程序,在几分钟内提供高质量的总RNA
●现成RNA在任何下游应用中高性能
●一致RNA产量从小到大量的起始材料
●无苯酚/氯仿萃取,无氯化铯梯度,无氯化锂或乙醇沉淀
●高通量96孔格式处理和自动化协议
三、产品性能展示
RNeasy试剂盒和QIAwave RNA试剂盒可从小到大的样本中提供高度可重复的总RNA产量。总RNA可以从少量细胞(包括单个细胞)以及少量标准组织中可靠地纯化(见图“从单个细胞中可靠地分离RNA”,“高度可重复的敏感应用产量”和“来自细针抽吸的高质量总RNA”)使用RNeasy微试剂盒。使用 RNeasy Micro Kit 提纯的RNA在定量基因表达分析(如实时 RT-PCR)中提供了很大灵敏度,通过高效地柱上消化基因组 DNA(见图“高效柱上去除基因组DNA”)。
总RNA易于从动物或人类细胞、动物或人类组织以及酵母中纯化(见表“使用RNeasy试剂盒获得的总RNA产量”和图“最多从100个细胞中提取的RNA的RT-PCR”)。
QIAwave RNA Mini Kit 让您从动物或人类细胞、动物或人类组织以及酵母中获得高度可重复的RNA产量(见表“使用RNeasy和QIAwave RNA试剂盒获得的总RNA产量")。我们的QIAwave RNA迷你试剂盒和RNeasy迷你 试用品之间的性能是相同的,因为化学成分相同。我们还展示了两个试剂盒的性能都优于竞争对手的试剂盒(见图 "QIAwave RNA迷你试剂盒性能")。
专用的 RNeasy Mini QIAcube 试剂盒,包括预装 RNeasy 旋转柱和洗脱管的转子适配器,提供了更大的便利和节省时间(见图 "使用专用 QIAcube 试剂盒节省大量时间" )。
使用 RNeasy Maxi 试剂盒纯化的总 RNA 质量高,适用于许多下游应用(见图“来自多种样品的优质 RNA”)。总RNA很容易用RNeasy Maxi Kit从大量的起始材料中纯化,包括动物或人细胞、动物或人组织以及酵母细胞(见表“使用RNeasy Kit获得的总RNA产量”)。
RNeasy 96系统为高通量基因表达谱分析提供快速可重复的总RNA纯化。RNA适用于敏感的应用,如定量、实时RT-PCR和微阵列分析(见图 "用于低拷贝转录本敏感分析的优质RNA" )。样本量从10到5x105个细胞(见图"从100个细胞中提取RNA的RT-PCR" ),并且可以从大量样品中纯化高质量的RNA(见图 “可重复的高质量RNA产量”)。在整个纯化过程中,个体差异很低;TaqMan ®阈值循环值在过程结束时很容易实现,变异系数(CV)小于3%,使用QuantiTect Probe RT-PCR试剂盒(见图“全自动RNA纯化的可重复性”)。
.jpg)
从单个细胞中出可靠的分离RNA。
使用RNeasy微试剂盒从指定数量的Hela细胞中分离总RNA。[A]放大图。[B]交叉点(Cp)值与细胞数的相关性。使用实时荧光定量探针RT-PCR试剂盒在光循环系统上进行实时RT-PCR检测,并使用针对β-actin的引物和探针。
.jpg)
高度可重复的敏感应用产量。
使用RNeasy Micro Kit,由5个不同的使用者从2mg的大鼠组织中分离总RNA。采用定量探针RT-PCR试剂盒在ABI序列检测系统上进行定量、实时RT-PCR,采用针对c-jun的引物和探针。
.jpg)
来自细针抽吸的高质量总RNA。
使用19.5-qauge活检针从兔肝中获得细针吸出物,样本立即稳定在RNA保护组织管中。总RNA使用RNeasy Micro Kit进行分离。用安捷伦2100生物分析仪扫描显示了高质量的RNAis。
.jpg)
高效柱上去除基因组DNA。
使用RNeasy微试剂盒从指定数量的Hela细胞中分离总RNA。采用QuantiTect探针PCR试剂盒,采用针对c-jun的引物和探针。为了评价柱上DNase酶切的效率,每个样品在逆转录+RT后进行直接扩增,不需要逆转录步骤(-RT)。在“-RT”样本中缺乏信号表明没有检测到DNA。在“-RT”结果中,只有50.000个单元格数据点是可见的。
.jpg)
仅从100个细胞中提取RNA的RT-PCR。
用RNeasy Mini Kit从指定数量的Hela细胞中分离的总RNA进行RT-PCR检测。10ul(1/5)洗脱液用无rnose的DNase酶切,用cDNA混合物的oligo-dT primer.2.5μl(1/20)逆转录,进行50μl PCR。扩增了一个452bp的GAPDHs片段。C-:阴性载体|C+:阳性对照;M:100bp阶梯。
使用 RNeasy 和 QIAwave RNA 试剂盒获得的总RNA产量
|
Source
|
Starting material
|
Average yield
|
||||||||
|
Animal cells
|
Micro
|
Mini/
QIAwave
Mini
|
Midi
|
Maxi
|
96-well
|
Micro
|
Mini/
QIAwave
Mini
|
Midi
|
Maxi
|
96-well
|
|
LMH
|
5x105
|
1x106
|
7x107
|
5x108
|
1x105
|
6µg
|
12µg
|
850µg
|
5.7mg
|
1.3µg*
|
|
HeLa
|
5x105
|
1x106
|
7x107
|
4x108
|
1x105
|
5µg
|
15µg
|
1000µg
|
6.0mg
|
1.6µg*
|
|
COS-7
|
5x105
|
1x106
|
3x107
|
1.8x108
|
1x105
|
17.5µg
|
35µg
|
950µg
|
5.8mg
|
3.1µg*
|
|
Lymphocytes
(unstimulated)
|
5x105
|
1x106
|
1x108
|
5x108
|
–
|
–
|
0.5µg
|
50µg
|
0.3mg
|
–
|
|
Huh7
|
5x105
|
–
|
–
|
–
|
1x105
|
7.5µg
|
–
|
–
|
–
|
2.0µg*
|
|
Jurkat
|
5x105
|
–
|
–
|
–
|
1x105
|
–
|
–
|
–
|
–
|
1.4µg*
|
|
Mouse tissue
|
|
|||||||||
|
Liver
|
5mg
|
10mg
|
200mg
|
1g
|
–
|
15µg
|
40µg
|
700µg
|
3.6mg
|
–
|
|
Lung
|
5mg
|
10mg
|
100mg
|
0.5g
|
–
|
5µg
|
10µg
|
130µg
|
0.6mg
|
–
|
|
Spleen
|
5mg
|
10mg
|
200mg
|
1g
|
–
|
15µg
|
35µg
|
600µg
|
3.2mg
|
–
|
|
Yeast cells
|
|
|||||||||
|
S. cerevisiae
|
–
|
1 x 107
|
2x108
|
1x109
|
–
|
–
|
25µg
|
450µg
|
2.4mg
|
–
|
*数量可能因发育阶段、所用的生长条件等而有所不同。
.jpg)
QIAwave RNA迷你试剂盒性能。
使用QIAwave RNA迷你试剂盒、RNeasy迷你试剂盒或供应商n的试剂盒从1x106 Jurkat细胞中纯化RNA。在纯化过程中,通过DNase I消化去除gDNA污染,纯RNA在无RNase的水中洗脱。用荧光计测定总RNA产量。
.jpg)
使用专用 QIAcube 试剂盒可节省大量时间。
使用手工处理、使用QIAcube和使用QIAcube与专用套件进行样本准备所需的实际操作时间的平均百分比。值可能略有不同,取决于QIAcube应用程序和所使用的套件。
.jpg)
来自多种样品的优质RNA。
用RNeasy Maxi试剂盒纯化的甲醛琼脂糖凝胶和总RNA的北玻片。从每个来源分离出的总RNA(10μg)被装载在每车道上。所有组织均来自小鼠。酵母:酿酒酵母;大肠杆菌菌株:HB101。32 P-标记的探针识别(G)GAPDH;(E)翻译延伸因子EF-1α;和(O)外膜蛋白A序列。(E和O分别由P. Philippsen,瑞士巴塞尔大学和U. Henning,德国蒂宾根马克斯·普朗克生物研究所提供。)枯草芽孢杆菌未进行探测。M :0.24-9.5 kb RNA阶梯。7.5 kb波段(指示)在胚胎、Huh7和HeLa细胞通道中是一种核前体RNA。
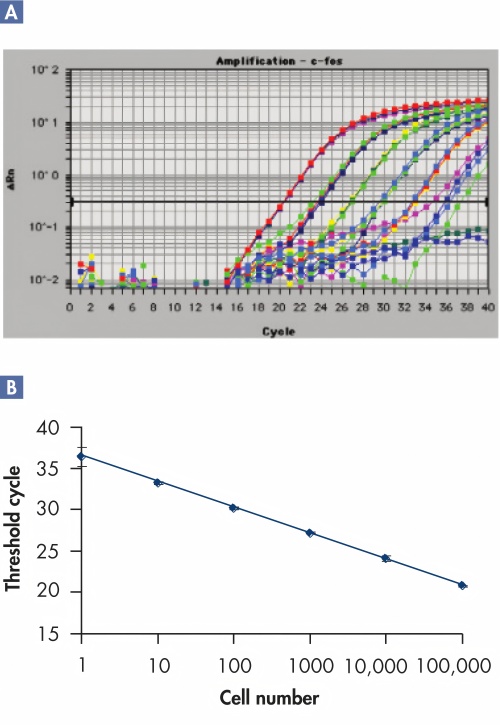
用于低拷贝转录本敏感分析的优质RNA。
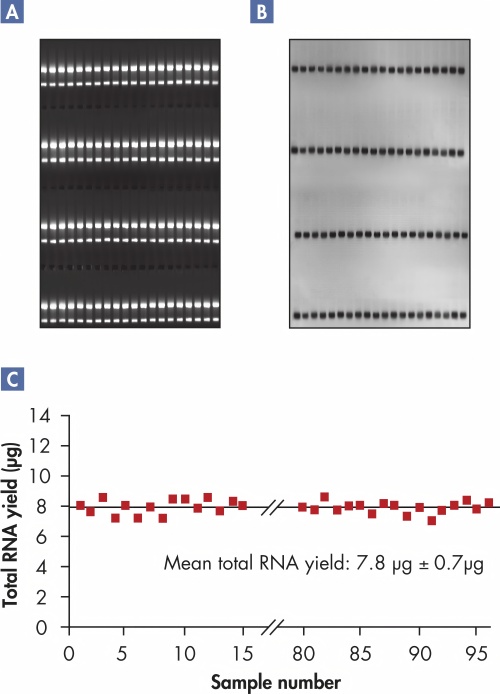
可重复的高质量RNA产量。
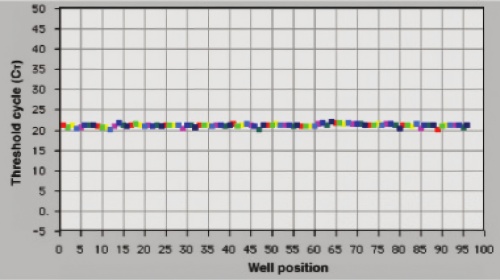
全自动RNA纯化的可重复性。
四、应用程序
使用 RNeasy 和 QIAwave RNA 技术纯化的 RNA 260/280 比值为 1.9-2.1(在 10 mM Tris·Cl,pH 7.5 中测量),适用于所有应用。下游应用包括:
▶RNA测序
▶定量实时RT-PCR
▶从仅一个细胞开始的实时RT-PCR
▶终点RT-PCR
▶北方、点状和槽状斑点
▶阵列分析
▶poly A+ RNA选择
五、试剂盒组份表
|
RNeasy Mini Kit
|
(50)
|
|
Catalog no.
|
74104
|
|
Number of preps
|
50
|
|
RNeasy Mini Spin Columns (pink)
|
50
|
|
Collection Tubes (1.5ml)
|
50
|
|
Collection Tubes (2ml)
|
50
|
|
Buffer RLT
|
45ml
|
|
Buffer RW1
|
45ml
|
|
Buffer RPE(concentrate)
|
11ml
|
|
RNAse-Free Water
|
10ml
|
|
Quick-Start Protocol
|
2
|
六、实验原理
1.样本裂解:使用含高浓度胍盐的Buffer RLT裂解样本,破坏细胞膜和核膜,释放RNA,并使RNase失活,保护RNA不被降解。
2.RNA结合:裂解液中加入乙醇调节核酸结合条件后,将样本裂解物加载到RNeasy Mini Spin Columns上,RNA在高盐条件下特异性吸附于硅胶膜表面。
3.杂质洗涤:通过Buffer RW1去除残留的蛋白质、多糖等大分子杂质,再用经乙醇稀释的Buffer RPE洗涤去除盐分和小分子污染物,确保硅胶膜上仅保留RNA。
4.RNA洗脱:用无RNase的RW1-Free Water或低盐缓冲液(如TE缓冲液)洗脱硅胶膜上的RNA,获得高纯度、高完整性的总RNA。
七、操作步骤概要
(1)样本准备:
1.培养细胞:直接加入Buffer RLT裂解,或离心收集细胞后重悬裂解。
2.动物组织:新鲜或冷冻组织需在液氮中研磨成粉末后加入Buffer RLT裂解。
3.植物/细菌/酵母:根据样本类型,可能需要先进行预处理(如酶解、机械破碎)后再加入Buffer RLT。
(2)RNA结合:
向裂解液中加入指定体积的70%乙醇,混匀后将混合物转移至RNeasy Mini Spin Column,12,000×g离心30~60秒,弃滤液。
(3)洗涤:
1.加入Buffer RW1至离心柱,12,000×g离心30~60秒,弃滤液和收集管。
2.将离心柱转移至新的2ml收集管,加入经乙醇稀释的Buffer RPE,12,000×g离心30–60秒,弃滤液。
3.重复加入Buffer RPE进行第二次洗涤,12,000×g离心2分钟,彻底去除残留洗涤液。
(4)RNA洗脱:
将离心柱转移至1.5ml收集管,加入30–50μl RNase-Free Water(可根据需要调整体积),室温静置1分钟,12,000×g离心1分钟,洗脱RNA。
八、注意事项
1.RNase污染防控:实验全程需严格遵守无RNase操作规范,使用无RNase的离心管、吸头及试剂,戴一次性手套并勤更换,避免徒手接触离心柱膜和RNA洗脱区域。
2.Buffer RPE准备:使用前必须按照说明书要求向Buffer RPE中加入指定体积的无水乙醇(通常为4 volumes),并在瓶上做好标记。
3.样本量控制:避免过量上样,以免超过离心柱的RNA结合容量,影响纯化效率和纯度。
4.洗脱效率:为提高RNA回收率,可将洗脱液在离心柱膜上静置2分钟后再离心,或进行二次洗脱(第二次洗脱体积可减半)。
5.安全提示:Buffer RLT含有刺激性化学物质,操作时应戴手套和护目镜,避免接触皮肤和黏膜,若不慎接触,立即用大量清水冲洗。
九、故障排除(常见问题与解决方案)
|
问题
|
可能原因
|
解决方案
|
|
RNA产量低
|
样本裂解不充分;
洗脱体积过大;
离心柱堵塞
|
确保样本彻底裂解(如组织研磨充分);
减少洗脱体积(如使用30μl);
离心前确保裂解液无沉淀
|
|
RNA纯度低
(OD260/OD280<1.8)
|
蛋白质残留;
Buffer RPE洗涤不充分
|
增加Buffer RW1洗涤次数;
确保Buffer RPE按要求加入乙醇并充分洗涤;
避免样本过量
|
|
RNA降解
|
样本处理时间过长;
RNase污染
|
使用新鲜样本并快速处理;
严格无RNase操作;
确保Buffer RLT充分裂解并失活RNase
|
十、存储
RNeasy Mini Kit、RNeasy Protect Mini Kit(包括RNAprotect Tissue Reagent)和RNeasy Plant Mini Kit应储存在室温(15~25°C)干燥环境中,若标签上无其他说明,则在该条件下可稳定储存至少9个月。
RNAprotect试剂在较低温度下储存可能引起沉淀,使用前将沉淀物加热至37°C并振荡使其重新溶解。
十一、引用文献
Alpha-calcitonin gene-related peptide can reverse the catabolic influence of UHMWPE particles on RANKL expression in primary human osteoblasts.
Kauther MD; Xu J; Wedemeyer C;
Int J Biol Sci; 2010; 6 (6):525-36 2010 Sep 15 PMID:20877694
Characterization of immortalized choroid plexus epithelial cell lines for studies of transport processes across the blood-cerebrospinal fluid barrier.
Kläs J; Wolburg H; Terasaki T; Fricker G; Reichel V;
Cerebrospinal Fluid Res; 2010; 7 :11 2010 Aug 12 PMID:20704740
Notch and Wnt signaling mediated rod photoreceptor regeneration by Müller cells in adult mammalian retina.
Del Debbio CB; Balasubramanian S; Parameswaran S; Chaudhuri A; Qiu F; Ahmad I;
PLoS One; 2010; 5 (8):e12425 2010 Aug 26 PMID:20865053
Facilitated leaky scanning and atypical ribosome shunting direct downstream translation initiation on the tricistronic S1 mRNA of avian reovirus.
Racine T; Duncan R;
Nucleic Acids Res; 2010; 38 (20):7260-72 2010 Jul 7 PMID:20610435
High-definition DNA methylation profiles from breast and ovarian carcinoma cell lines with differing doxorubicin resistance.
Boettcher M; Kischkel F; Hoheisel JD;
PLoS One; 2010; 5 (6):e11002 2010 Jun 8 PMID:20544021